科学博文 | 突破耐药壁垒: KRAS G12C抑制剂耐药肿瘤模型的开发

·· 引言 ··
安进(Amgen)公司和Mirati Therapeutics公司分别开发了选择性、不可逆的KRAS G12C抑制剂Sotorasib (AMG510)和Adagrasib (MRTX849),这两种药物采用了相似的研发策略,靶向KRASG12C结合口袋Switch II,共价结合半胱氨酸残基,使KRASG12C锁定在失活状态(KRAS-GDP结合),从而抑制肿瘤的生长(Figure 1)。这些抑制剂的成功获批打破了RAS被认为不可成药靶点的传统观念,为RAS药物开发开辟了新的前景。
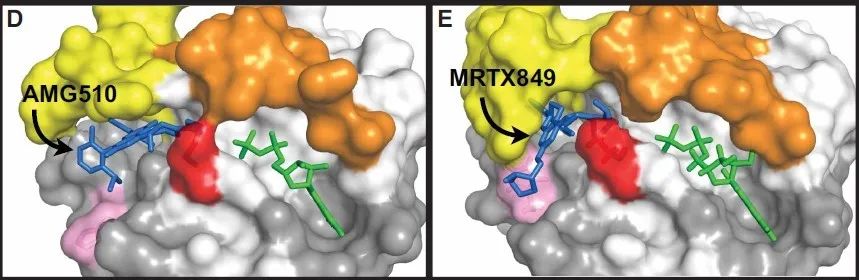
Figure 1. Structures of KRAS bound to selected G12C inhibitors [Biochem Soc Trans. 2020 Oct 30; 48(5): 1831–1841.]
尽管KRAS G12C抑制剂在临床上表现出令人鼓舞的疗效,但获得性耐药(如G12D、Y96C、R68S、Q61H等继发性KRAS突变)仍然是一个重大挑战,限制了患者的长期临床获益(图2)。
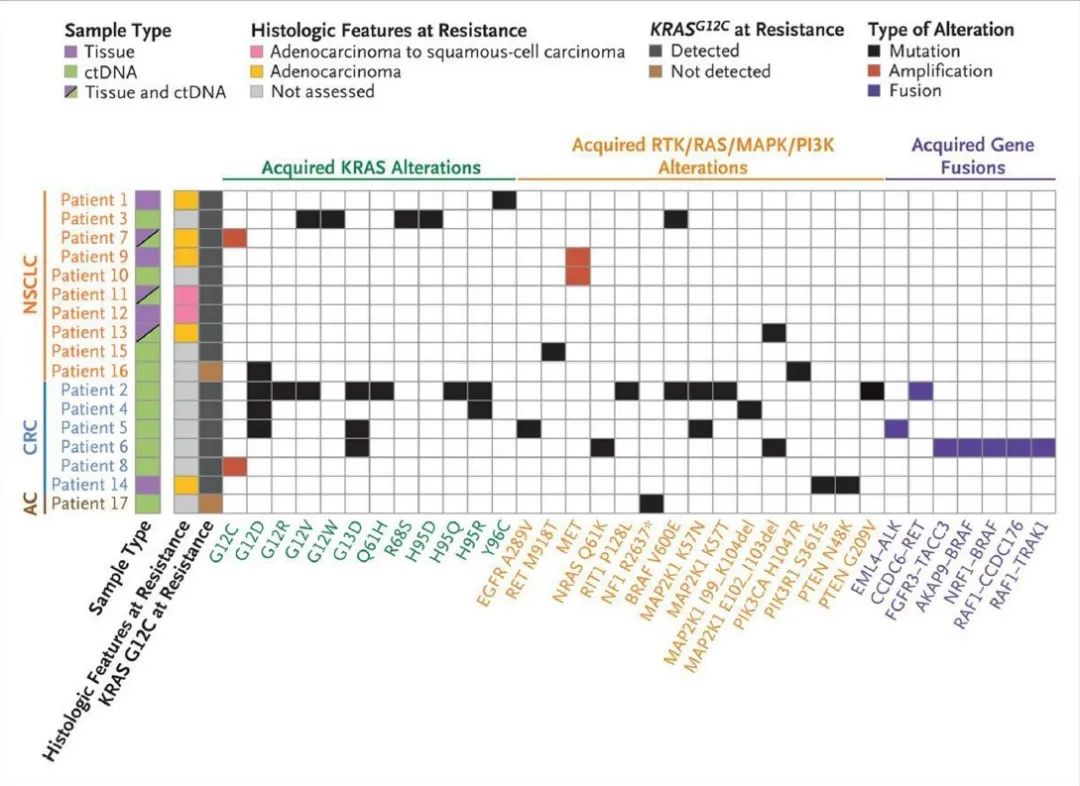
Figure 2. Summary of Putative Mechanisms of Acquired Resistance to KRAS G12C inhibitor Treatment. [N Engl J Med. 2021 June 24; 384(25): 2382–2393.]

·· 冠科生物耐药模型··
临床耐药经治PDX模型(Clinical pretreated PDX model):来源于临床治疗后耐药的病人肿瘤样本。
药物诱导耐药PDX模型(drug induced resistant PDX model):通过体内诱导耐药。
基因改造耐药CDX模型gene engineered resistant CDX model):利用基因改造细胞系建立(表1)。
···
··KRAS G12C抑制剂临床经治PDX模型··
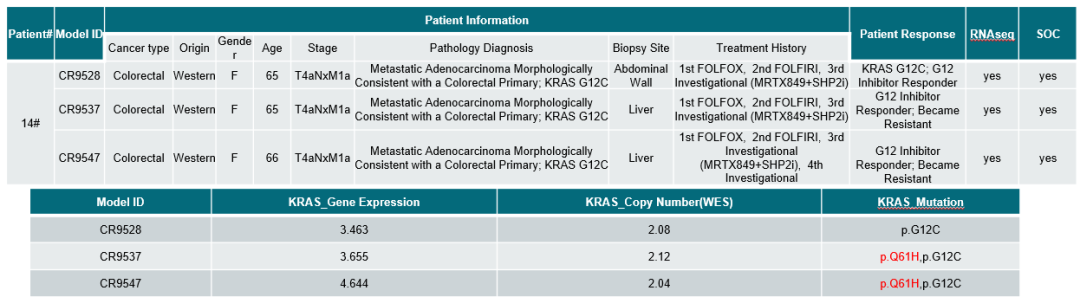
Table 1. MRTX849 Pretreated CRC PDX models
我们利用同一病人在不同治疗阶段的结肠癌肿瘤样本建立了一系列PDX模型。CR9528模型来自对MRTX849和SHP2抑制剂联合治疗有临床获益的肿瘤组织。CR9537模型来源于联合治疗复发后的肿瘤组织。CR9547模型则是患者在另一项未公开的研究治疗后的肿瘤组织建立的。RNA测序(RNA-seq)和全外显子组测序(WES)数据表明,CR9528肿瘤含有KRASG12C突变。除了KRASG12C突变外,CR9537和CR9547还显示出KRASQ61H突变(图3
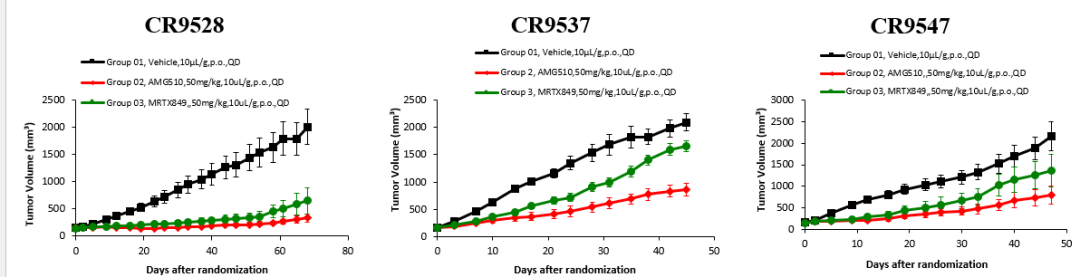
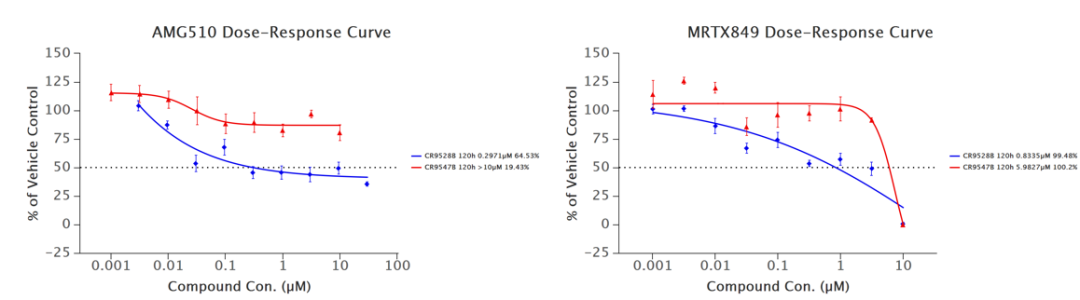
Figure 3. The treatment of KRAS G12C inhibitors in pretreated CRC PDX and PDXO models
与临床观察一致,AMG510和MRTX849在CR9528模型中均表现出显著的抗肿瘤效果(图3)。在治疗第68天,肿瘤抑制率(TGI)分别为90%和73%(均p<0.001)。然而,CR9537模型在第45天对MRTX849治疗表现出耐药性,TGI仅为23%(p>0.05),而AMG510的抗肿瘤作用显著降低,TGI为64%(p<0.001)。同样,MRTX849在CR9547模型中的肿瘤生长仅部分抑制,治疗第47天的TGI为40%(p>0.05)。AMG510在CR9547中也能诱导部分缓解,TGI为68%(p<0.01)。在PDXO模型中也发现了类似的结果。
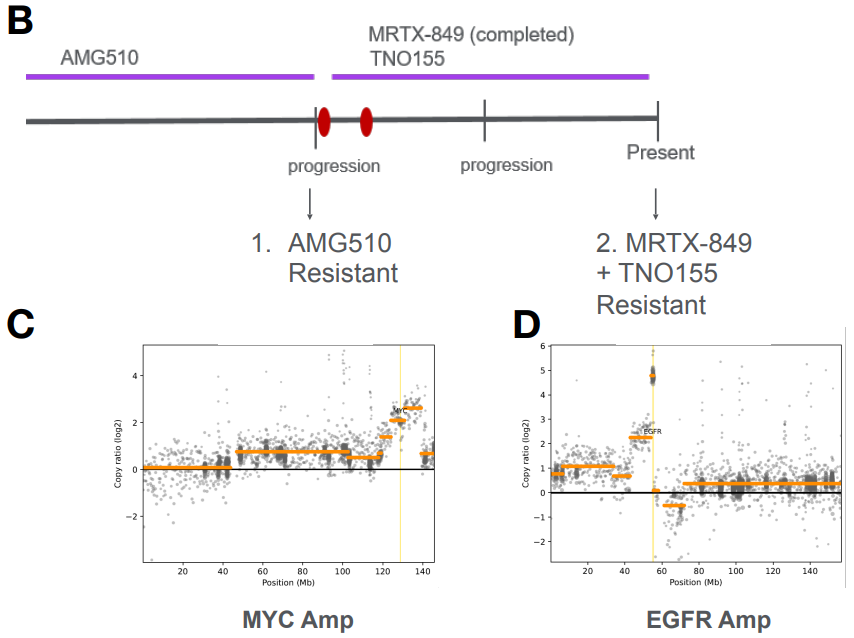
Figure 4. Schematic diagram of clinical treatment schedule

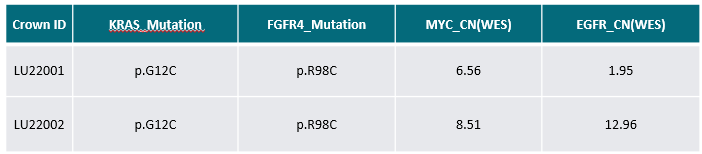
Table 2. AMG510 and MRTX849 pretreated lung cancer PDX models
我们同样利用不同治疗阶段患者的肺癌肿瘤样本建立了一系列PDX模型。LU22001模型来源于对AMG510治疗表现出临床耐药的肿瘤组织。RNA-seq和WES数据表明其肿瘤含有KRASG12C突变、FGFR4突变和MYC扩增。LU22002模型来源于在AMG510治疗后,联合MRTX849和SHP2抑制剂TNO155治疗后表现出耐药的肿瘤组织(图5)。RNA-seq和WES数据表明,该肿瘤不仅含有LU22001模型中的所有基因突变和扩增,还显示出EGFR扩增。
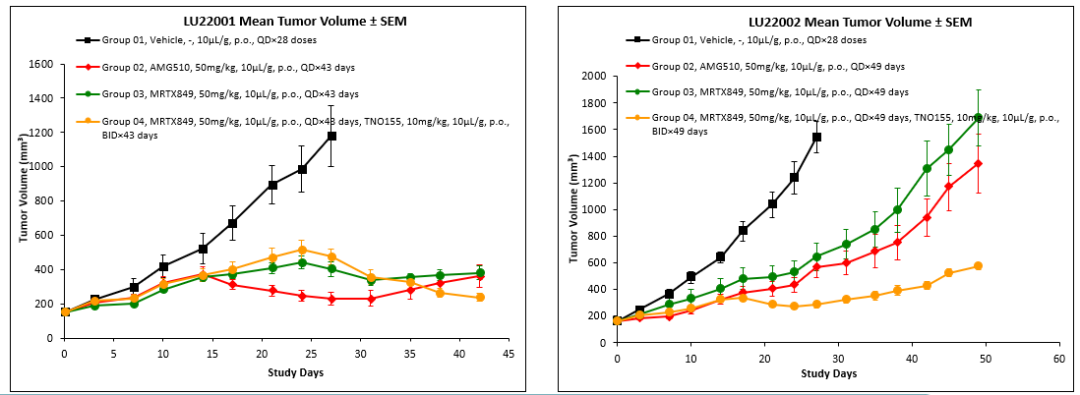
Figure 5. The treatment of KRAS G12C inhibitors in pretreated lung cancer PDX models
与临床观察一致,在LU22001模型中,尽管AMG510(治疗第27天,TGI=93%)或MRTX849(治疗第27天,TGI=76%)表现出一定疗效,但肿瘤继续生长,临床标准认为是部分缓解。然而,MRTX849与TNO155联合治疗更好地控制了疾病进展,治疗第27天TGI为69%,并且肿瘤持续缩小。而在LU22002模型中,无论是AMG510(治疗第27天,TGI=70%)、MRTX849(治疗第27天,TGI=65%)单药治疗,还是MRTX849与TNO155联合治疗(治疗第27天,TGI=91%),肿瘤均持续生长,临床标准认为是疾病进展。

··KRAS G12C抑制剂诱导的耐药PDX模型··
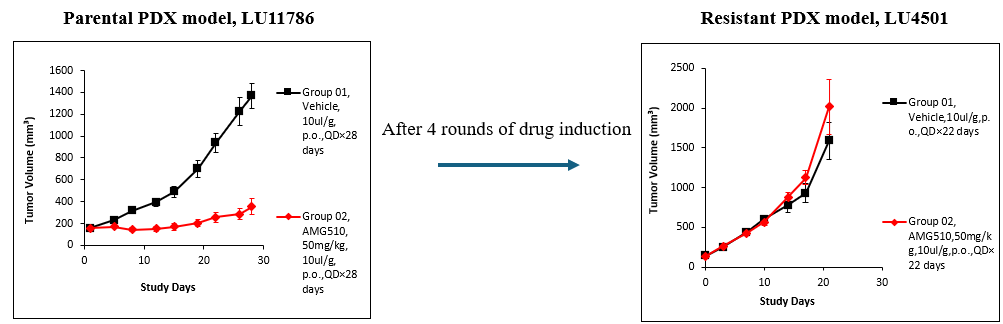
Figure 6. The development of AMG510 induced resistant lung cancer PDX model
在非小细胞肺癌PDX模型LU11786中,携带KRASG12C突变的肿瘤在AMG510治疗初期(50 mg/kg)显示良好反应,治疗第28天TGI为84%(p<0.001)。但经过体内反复给药后,诱导出新的对AMG510耐药的PDX模型LU4501。其潜在的耐药机制正在进一步研究中(图6)。
···
··基因改造耐药细胞系和CDX模型··
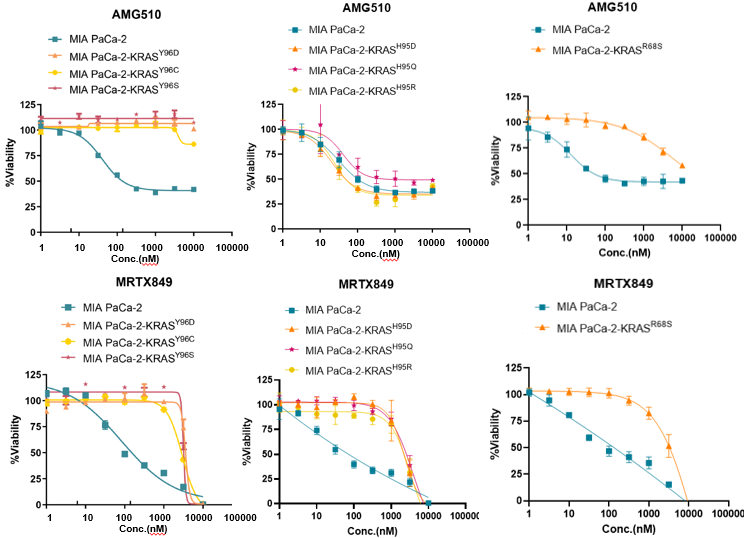
Figure 7. Cellular characterization of MIA PaCa-2-KRAS mutant cells in vitro
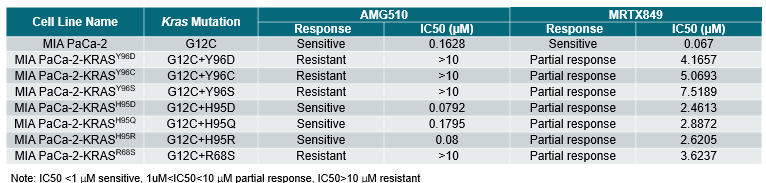
Table 3. Summary of anti-tumor response of KRAS G12C inhibitors in MIA PaCa-2-KRAS mutant cells in vitro
除了PDX模型外,我们还利用携带KRASG12C突变的MIA PaCa-2胰腺癌细胞系,构建了一系列具有继发突变的基因改造细胞株。Sanger测序确认成功引入了纯合点突变。与亲本细胞相比,新构建的细胞显示出相似的生长速率和形态。体外实验结果表明,H95D、H95Q、H95R和R68S对AMG510和MRTX849均表现出高度耐药性,其IC50值较亲本细胞系增加了100倍以上(表3)。
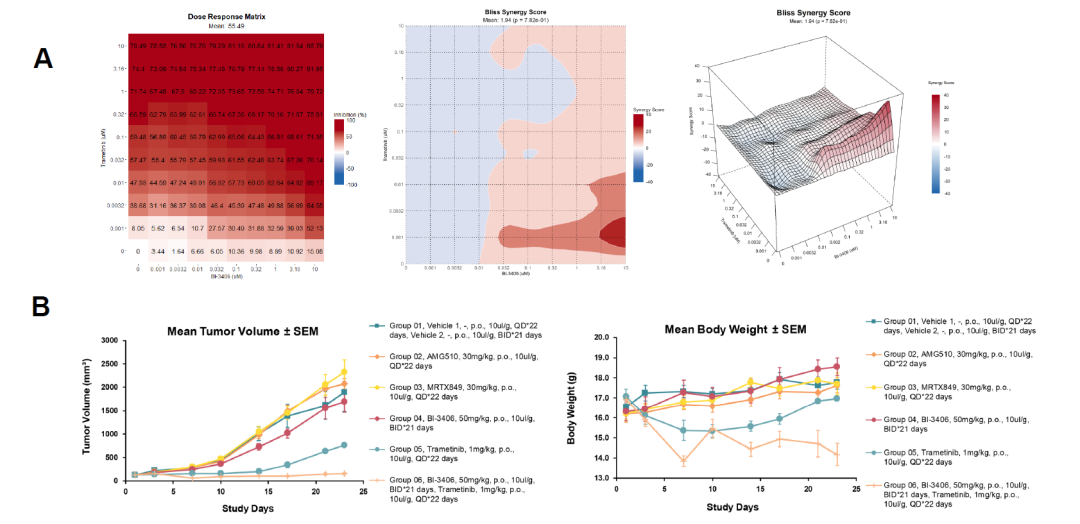
Figure 8. Combination treatment for MIA Paca-2 hKRASY96D cell in vitro and in vivo
[AACR24 poster 1942, Developing KRAS G12C Inhibitor-Resistant Tumor Models for Efficacy Evaluation of Next-Generation Anticancer Therapies]
此外,体内研究表明,MIA PaCa-2-KRASY96D模型对AMG510(30 mg/kg)和MRTX849(30 mg/kg)均表现出耐药性。然而,SOS1抑制剂BI-3406(单药治疗,TGI=27%,第17天)和MEK抑制剂Trametinib(单药治疗,TGI=76%,第17天)联合治疗可抑制肿瘤生长(图7)。与对照组相比,联合治疗第17天的TGI为93%(p<0.001)。联合治疗的疗效优于BI-3406单药治疗(p<0.001),但与Trametinib单药治疗相比无显著差异(p>0.05)。我们采用Bliss独立模型分析BI-3406和Trametinib在MIA PaCa-2 hKRASY96D模型中的协同效应。结果显示,平均协同效应得分(Synergy Score,SS)为1.94。协同效应得分高于5表示有协同作用,低于-5表示有拮抗作用(如图8A所示)。因此,我们得出结论,在MIA PaCa-2 hKRASY96D体外模型中,BI-3406和Trametinib未表现出协同效应。
···
··结论··
冠科生物成功开发了一系列KRAS G12C抑制剂耐药性肿瘤模型,包括来自临床治疗史病人肿瘤样本的PDX和PDXO模型、通过体内诱导耐药的PDX模型以及基因改造细胞系来源的CDX模型。这些模型可用于评估下一代KRAS G12C抑制剂和联合治疗策略,为药物开发提供了极具价值的体内外评价体系。致力于帮助客户缩短新药研发周期,助力临床前药物研发。

··新平台预告··
此外,我们还利用自主开发的即用型类器官模型,推出了大规模类器官药物筛选平台OrganoidXplore。该平台能够经济高效地进行药物检测,即使是单个化合物,也能在一两周内完成实验,并在3-4周内得到最终分析结果。OrganoidXplore目前拥有50个模型,包括一个由24个模型组成的KRAS模型库,涵盖了野生型和常见的KRAS突变模型(如G12X、G13X等)。这些模型可用于KRAS抑制剂药效的高通量快速筛选,为药物开发提供了更加便捷和高效的解决方案。
更多RAS抑制剂相关研究请查阅 “模型巡礼 | 撕掉“Undruggable”标签 -RAS抑制剂的研究出路”
欢迎联系冠科生物商务和科学支持团队了解冠科生物一站式服务平台和其他药物开发评价平台,我们乐意为您定制相关的药物研发解决方案和临床前服务。如果有进一步问题需要沟通和资料索取,可随时与我们邮件联系: businessdevelopmentchina@crownbio.com。
参考文献:
1. Biochem Soc Trans. 2020 Oct 30; 48(5): 1831–1841.
2. N Engl J Med. 2021 June 24; 384(25): 2382–2393.
3. AACR24 poster 1942, Developing KRAS G12C Inhibitor-Resistant Tumor Models for Efficacy Evaluation of Next-Generation Anticancer Therapies
···
··关于我们··
冠科生物成立于2006年,现为JSR生命科学集团旗下子公司。公司总部位于加利福尼亚圣地亚哥,在美洲、欧洲、亚洲都设有分公司及研发中心。作为一家临床前CRO公司,冠科生物为客户提供临床前及转化医学平台服务,专注于肿瘤、肿瘤免疫领域的体内外药物发现与研发。冠科生物拥有全球范围内可观的可商用PDX模型库。作为获得荷兰HUB独家授权的临床前CRO,可使用其技术为客户提供肿瘤类器官商业化服务。仅2021年,冠科生物就为FDA审批通过的13款肿瘤药物中的6款做出了贡献。冠科生物助力客户选择更有效的肿瘤候选药物,以确保病人“病有所医,及时医治”。

关注“冠科生物科技”订阅号

关注“冠科生物CrownBio”服务号
商务合作请邮件至:BDChina@crownbio.com
版权声明
本文仅作者转发或者创作,不代表旺旺头条立场。
如有侵权请联系站长删除
 旺旺头条
旺旺头条





发表评论:
◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。